Alternative 10B-Zufuhrsysteme wie borhaltige Polymere, Emulsionen und Liposomen wurden als selektive Bor-Transportreagenzien untersucht. Diese Ansätze beinhalten Liganden, die auf bestimmte Rezeptoren abzielen, die auf der Oberfläche bestimmter Tumorzellen überexprimiert sind.
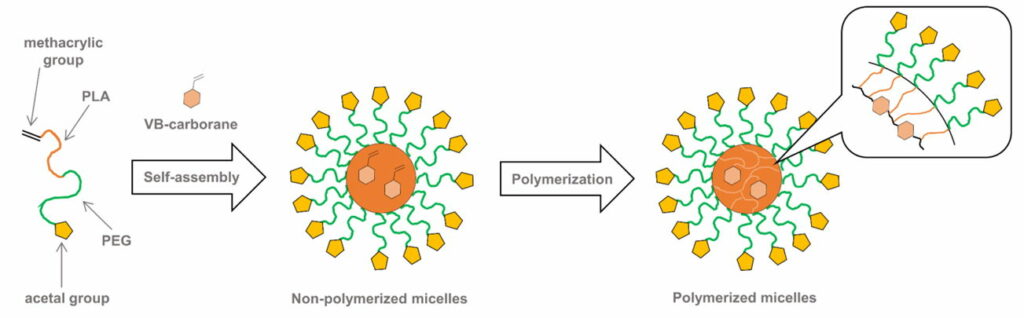
Kernvernetzte (core cross-linked, CL) und Carboran-haltige Micellen (CL-Micellen) wurden unter Verwendung der radikalischen Polymerisation von Poly(ethylenglykol)-Block-Poly(lactid)-Copolymer (PEG-b-PLA) synthetisiert (Abb. 4.1a). Die Ergebnisse von 125I-markierten CL-Micellen, die in tumortragenden BALB/c-Mäusen i.v. verabreicht wurden, deuteten auf eine geeignete Akkumulation im Tumor hin. Darüber hinaus wurde das Tumorwachstum von Mäusen, denen CL-Mizellen injiziert wurden, für 25 Tage nach der Neutronenbestrahlung unterdrückt.
Fig. 4.1a Schematische Darstellung der CL-Mizellen, die PEG-b-PLA-Copolymer enthalten
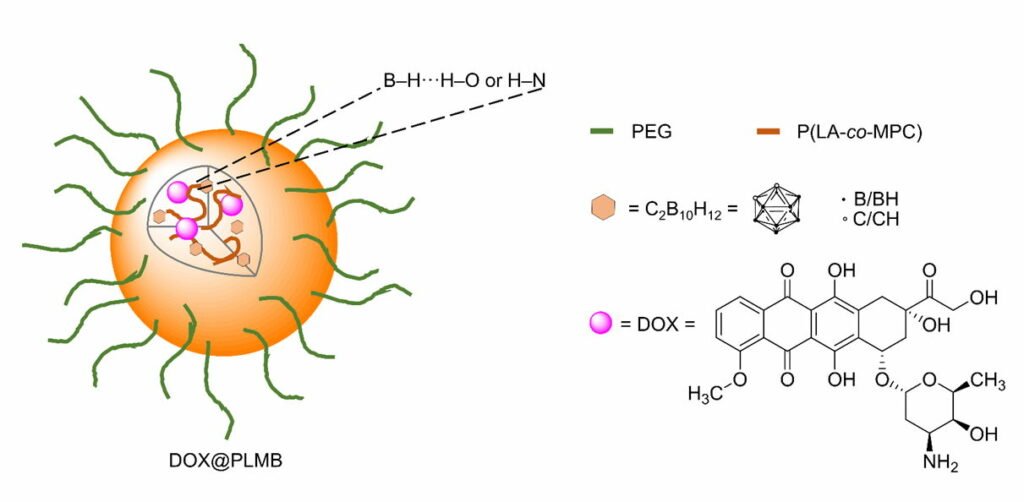
Mit Doxorubicin beladene Carboran-konjugierte polymere Nanopartikel (DOX@PLMB) (Abb. 4.1b) wurden hergestellt, um die Behandlungseffekte von BNCT und medikamentöser Chemotherapie zu kombinieren. Tatsächlich brachten die DOX@PLMB-Nanopartikel gleichzeitig Boratome und Doxorubicin selektiv in die Tumoren von Mäusen und verbesserten die Tumorsuppressionseffizienz im Vergleich zu nur mit Doxorubicin beladenen polymeren Nanopartikeln.
Fig. 4.1b Schematische Darstellung von DOX@PLMB mit seinen Komponenten
Darüber hinaus wurden drei Arten von größenkontrollierten, amphiphilen Carboran-konjugierten Polycarbonat-Nanopartikeln, PN50, PN90 und PN150 (50, 90 bzw. 150 nm Durchmesser), hergestellt und getestet. Es wurde eine größenabhängige Zellaufnahme beobachtet: Nanopartikel kleinerer Größe zeigten sowohl in vitro als auch in vivo eine höhere Akkumulation in Tumorzellen, was zu einem höheren in vivo-BNCT-Effekt nach Neutronenbestrahlung führte.
Hyaluronsäure (hyaluronic acid, HA) ist ein Glykosaminoglykan, das im Binde-, Epithel- und Nervengewebe weit verbreitet ist. Als einer der Hauptbestandteile der extrazellulären Matrix trägt HA wesentlich zur Zellproliferation und -migration bei und kann auch an der Progression einiger bösartiger Tumore beteiligt sein. Daher hat sich die HA als vielversprechender Kandidat für die intrazelluläre Verabreichung verschiedener therapeutischer und bildgebender Wirkstoffe herausgestellt, da sie in der Lage ist, spezifische zelluläre Rezeptoren zu erkennen, hauptsächlich den CD44-Rezeptor, der in vielen Histotypen überexprimiert wird.
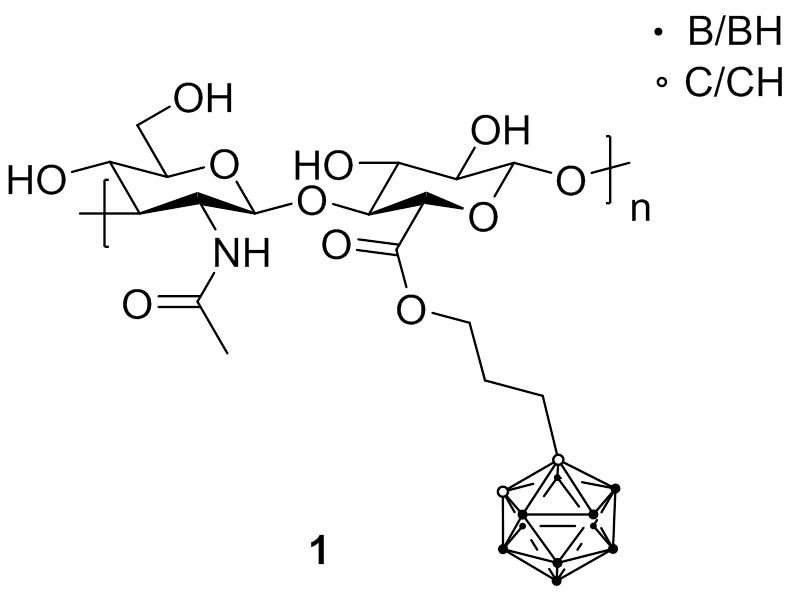
Erste Versuche, Borquellen mit HA zu kombinieren, wurden mit Carboranen durchgeführt (1). Biologische Studien zeigten, dass die borierte HA die Fähigkeit behielt, spezifisch mit dem CD44-Rezeptor zu interagieren und internalisiert zu werden, so dass ein erhöhter Boratomgehalt in den Zellen erreicht wurde.
Fig. 4.2 Hyaluronsäure-Carboran-Konjugat 1
Lipiodol ist ein iodiertes und verestertes Lipid des Mohnöls und wird zusammen mit Chemotherapeutika für die arterielle Chemoembolisation mittels Transkatheter verabreicht. Die intraarterielle Verabreichung einer BSH/Lipiodol-Emulsion lieferte selektiv hohe 10B-Konzentrationen (ca. 200 ppm 6 h nach Verabreichung) in experimentellen Lebertumoren. Diese hohe 10B-Akkumulation im Lebertumor kann auf die embolisierende Wirkung von Lipiodol auf die Tumorgefäße zurückgeführt werden.
Als Alternative wurde auch eine Wasser-in-Öl-Wasser-Emulsion (water-in-oil-water, WOW) als Träger von Antitumor-Wirkstoffen in arteriellen Injektionen bei der klinischen Krebsbehandlung verwendet. Zur Behandlung des Leberkarzinoms wurde eine mit BSH umhüllte WOW-Emulsion durch arterielle Injektionen über die Leberarterie (Arteria hepatica propria) verabreicht. Die Antitumor-Aktivität der Emulsion wurde mit der der BSH/Lipiodol-Emulsion oder BSH-Lösungen verglichen, wobei VX-2-Hepatozelluläre Tumormodelle in Kaninchen verwendet wurden. Die Konzentration von 10B im VX-2-Tumor bei Abgabe der WOW-Emulsion war der der konventionellen BSH/Lipiodol-Emulsion überlegen. Elektronenmikroskopische Bilder bestätigten die Akkumulation von Fetttröpfchen der WOW-Emulsion an der Tumorstelle, aber es gab keine Akkumulation von Fetttröpfchen der BSH/Lipiodol-Emulsion.
Die Entwicklung von lipophilen Borverbindungen, die in die Liposomen-Doppelschicht eingebettet sind, ist ein attraktives Mittel, um die Gesamteinbaueffizienz borhaltiger Spezies zu steigern und den Bruttoborgehalt der Liposomen zu erhöhen.
1991 wurde BSH, verkapselt in einem Liposom, das mit mAb konjugiert war, der spezifisch für karzinoembryonales Antigen (carcinoembryonic antigen, CEA) ist, als liposomales Transportsystem untersucht. Es konnte gezeigt werden, dass dieses Immunoliposom selektiv an menschliche Pankreaskarzinomzellen (AsPC-1) bindet, die CEA auf ihrer Oberfläche tragen, und dass es das Wachstum von Tumorzellen in vitro bei thermischer Neutronenbestrahlung hemmt. Darüber hinaus wurde die cytotoxische Wirkung lokal injizierter BSH-verkapselter Immunoliposome auf AsPC-1-Xenografts in Nacktmäusen untersucht. Nach i.t.-Injektion der Immunoliposomen lagen die Borkonzentrationen in Tumorgewebe und Blut bei etwa 50 ± 6 bzw. etwa 0,3 ± 0,1 ppm. Das Tumorwachstum bei Mäusen, die eine i.t.-Injektion von BSH-verkapselten Immunoliposomen erhielten, wurde nach thermischer Neutronenbestrahlung in vivo unterdrückt.
1992 wurden borverkapselte Liposomen mit mittleren Durchmessern von 70 nm oder weniger aus Distearoylphosphatidylcholin (DSPC) und Cholesterin hergestellt. Hydrolytisch stabile Boran-Anionen, B10H102−, B12H11SH2−, B20H17OH4−, B20H193− und B20H182− (zwei Isomere), wurden in den Liposomen als lösliche Natriumsalze eingekapselt. Die höchsten Borkonzentrationen im Tumor erreichten den therapeutischen Bereich (>15 μg von Bor pro g Tumor), während gleichzeitig hohe Tumor/Blut-Verhältnisse (>3) aufrechterhalten wurden. Die besten Ergebnisse wurden mit den beiden Isomeren von B20H182− erzielt. Diese Borverbindungen haben die Fähigkeit, mit intrazellulären Komponenten zu reagieren, nachdem sie von Liposomen in Tumorzellen deponiert worden sind, wodurch die Freisetzung der Borverbindungen ins Blut verhindert wird.
Selektive Borabgabe an Tumore durch lipophile Spezies, die in die Membranen von unilamellaren Liposomen eingebaut sind, wurde 1995 von Hawthorne und Mitarbeitern nachgewiesen. Sie synthetisierten ein nido-Carborat-Amphiphil (K[nido-7-CH3(CH2)15-7,8-C2B9H11], MAC) und präparierten borierte Liposomen, die aus Distearoylphosphatidylcholin (DSPC), Cholesterin und MAC in der Doppelschicht bestehen. Nach der Injektion liposomaler Suspensionen in BALB/c-Mäuse, die EMT6-Mammaria-Adenokarzinome trugen, wurde der zeitliche Verlauf der Bioverteilung von Bor untersucht. Bei niedrigen injizierten Dosen, die normalerweise verwendet werden (5-10 mg 10B/kg), wurde eine Spitzenkonzentration des Bors im Tumor von 35 μg Bor pro g Tumor und ein Tumor/Blut-Bor-Verhältnis von ~8 erreicht. Die Inkorporation sowohl der MAC als auch der hydrophilen Spezies TAC (Na3[ae-B20H17NH3]) in dieselben Liposomen verbesserte die Bioverteilungseigenschaften signifikant, wie die maximale Borkonzentration von 50 μg Bor pro g Tumor und das Tumor/Blut-Bor-Verhältnis von 6 zeigen. Dieses MAC-TAC-Liposom wurde i.v. in oralen Krebsmodellen in Hamstern getestet. Nach 48 Stunden betrug die Borkonzentration in den Tumoren 67 ppm, während das präkanzeröse Gewebe 11 ppm enthielt. Die Neutronenbestrahlung führte nach 4 Wochen zu einer Reduktion des Tumorwachstums um 70%.
Ein hoher Borgehalt in den Liposomen wurde durch die Verkapselung von closo-Dodecaborat-Derivaten, Na2[B12H12], Na[B12H11NH3] und BSH, erreicht. Die Verwendung von Spermidinium (spd) als Gegenkation von closo-Dodecaboraten war nicht nur für die Herstellung von Liposomenlösungen mit hohem Borgehalt, sondern auch für eine effiziente Borzufuhr zu Tumoren unerlässlich. Maximale Borkonzentrationen von 202,7 und 82,4 ppm im Tumor wurden 36 h nach der Injektion bei Dosen von 100 bzw. 30 mg [B]/kg erreicht. Darüber hinaus wurden 100 Tage nach der BNCT bei tumortragenden Mäusen, die mit spd-[BSH]-verkapselnden Liposomen in Dosen von 30 bzw. 15 mg [B]/kg behandelt wurden, Überlebensraten von 100 bzw. 70% beobachtet.
Die Transferrin (TF)-Rezeptor-vermittelte Endozytose ist ein normaler physiologischer Prozess, durch das TF Eisen an die Zellen abgibt. Bei den meisten Tumorzellen wurde im Vergleich zu normalen Zellen eine hohe Konzentration des TF-Rezeptors beobachtet. Daher wurden BSH-verkapselnde TF-konjugierte PEGylierte Liposomen (TF-PEG-Liposomen) entwickelt, und es konnte gezeigt werden, dass sie einen hohen 10B-Gehalt im Tumor aufrechterhalten, mit Konzentrationen von mehr als 30 μg Bor pro g Tumor für mindestens 72 h nach der Injektion. Auf der anderen Seite nahm der 10B-Gehalt im Plasma ab, was zu einem Tumor/Plasma-Verhältnis von 6,0 nach 72 h nach der Injektion führte. Die Verabreichung von in TF-PEG-Liposomen verkapseltem BSH in einer Dosis von 5 oder 20 mg 10B/kg, gefolgt von Neutronenbestrahlung, unterdrückte das Tumorwachstum und verbesserte das Langzeitüberleben im Vergleich zu PEG-Liposomen, nackten Liposomen und freiem BSH. Die Bioverteilung von BSH- und Na2[B10H10]-gekapselten TF-PEG-Liposomen in SCC VII-tumortragenden Mäusen wurde untersucht. Die Zeitverläufe der Veränderung der 10B-Konzentration in den mit je einem der beiden Liposomen beladenen Tumoren waren ähnlich, mit der Ausnahme, dass die 10B-Konzentration bei Na2[B10H10] nach 24 h höher war als die von BSH-TF-PEG-Liposomen und die 10B-Konzentration in den Tumoren 35,6 μg Bor pro g Tumor betrug, wenn Na2[B10H10]-TF-PEG-Liposomen (35 mg 10B/kg) injiziert wurden.
Silber- und Goldnanopartikel sind in letzter Zeit wegen ihrer besonderen physikalisch-chemischen Eigenschaften, wie Oberflächenplasmonenresonanz im sichtbaren oder nahen Infrarotbereich, Photolumineszenz und einstellbaren chemischen Funktionalisierung durch Bindung mit Thiol-, Amin- oder Carbonsäuregruppen, als mögliche Vehikel für die Medikamentenabgabe auf großes Interesse gestoßen.
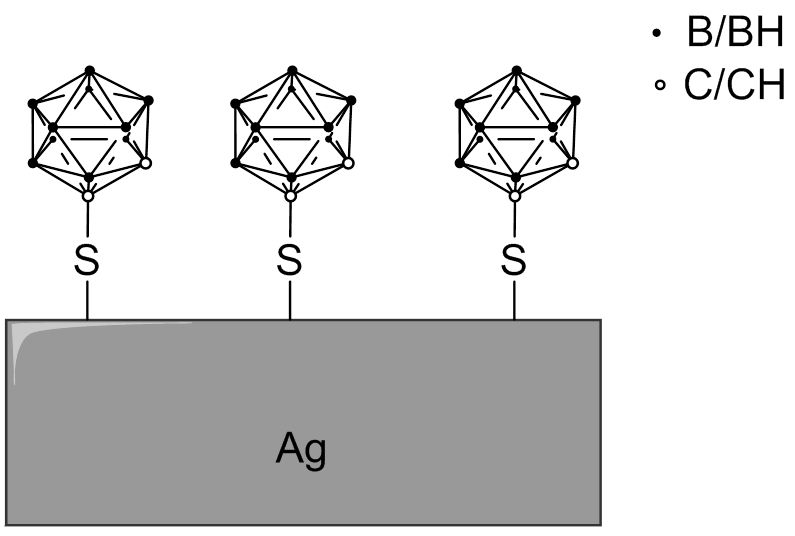
Es wurden wasserlösliche Carboran-funktionalisierte Silbernanopartikel entwickelt, die mit Anti-EGFR-Antikörpern konjugiert sind. Die oberflächenverstärkte Raman-Streuung (surface-enhanced Raman scattering, SERS-Mikroskopie) zeigte, dass die modifizierten Silbernanopartikel (Abb. 4.5) selektiv auf eine extrazelluläre Domäne des EGF-Rezeptors abzielten. Es wurde geschätzt, dass ein einzelnes 25 nm-Nanopartikel (Oberfläche ~2000 nm2) mit einer 45%igen Carboran-Beschichtung etwa 9000 Carboran-Moleküle pro Zielantikörper tragen würde.
Fig. 4.5 Schematische Darstellung der Oberfläche eines mit 1-Mercapto-1,2-dicarba-closo-dodecaboran-modifizierten Silbernanopartikels
Darüber hinaus wurden auch Goldnanopartikel als Borträger eingesetzt. So wurden z.B. Goldnanopartikel, die mit BPA, Folat und Fluoreszenzfarbstoff für die Bildgebung multifunktionalisiert sind, im Layer-by-Layer-Verfahren hergestellt. Die konfokale Fluoreszenzmikroskopie zeigte eine signifikante Aufnahme der funktionalisierten Goldnanopartikel in Folatrezeptor-überexprimierenden Krebszellen.
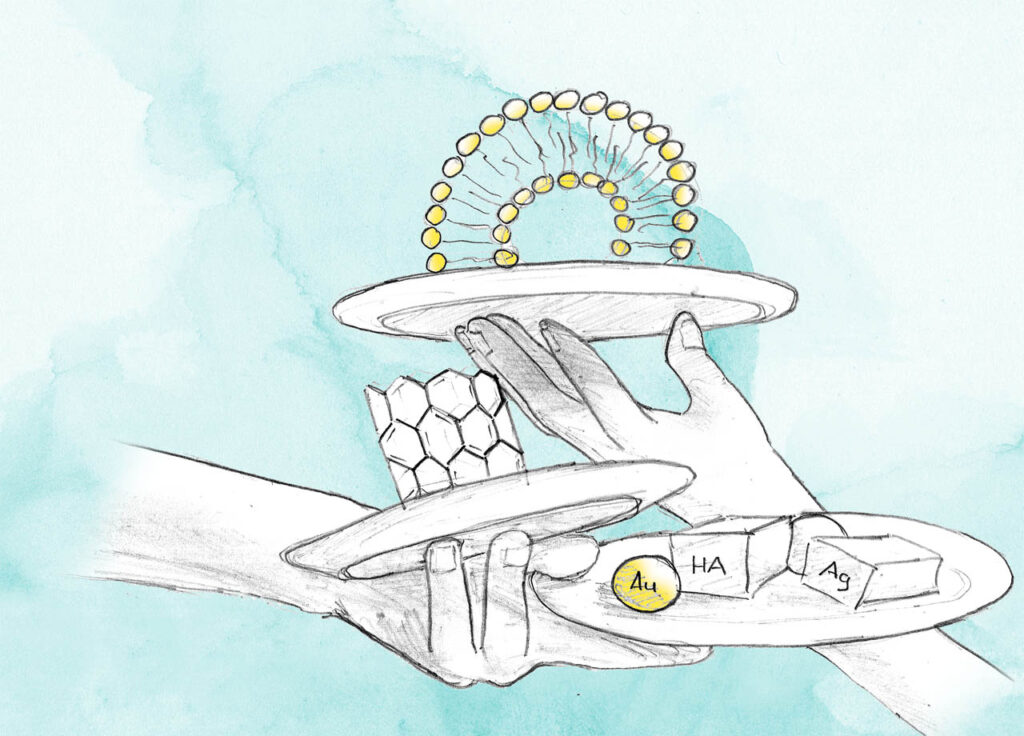
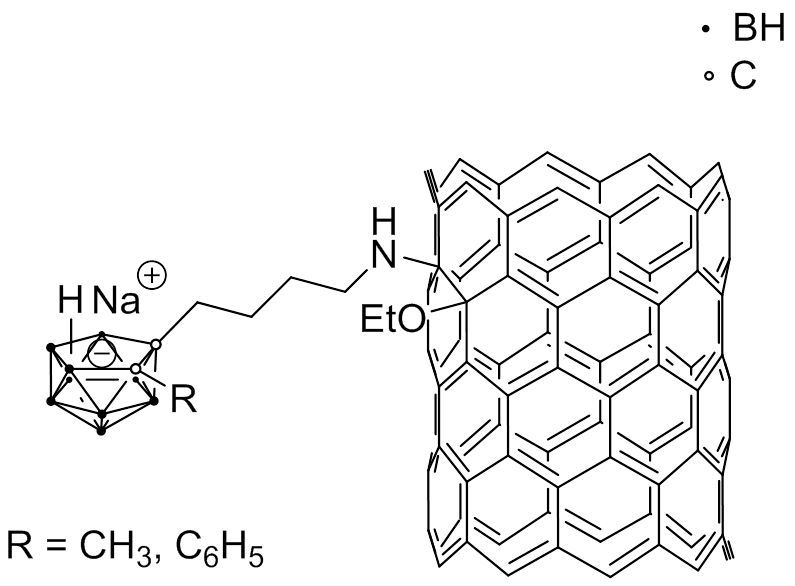
Da funktionalisierte einwandige Kohlenstoff-Nanoröhren (single-wall carbon nanotubes, SWCNTs) in der Lage sind, Zellmembranen zu passieren und sich in einer Reihe von neoplastischen Zellen ohne offensichtliche toxische Wirkungen anzureichern, wurden nido-Carborate an SWCNTs gebunden, um wasserlösliche makromolekulare Bor-Träger zu erzeugen (Abb. 4.6a). In vivo-Studien mit Mäusen, die einen EMT6-Mammakarzinom-Tumor trugen, zeigten 21,5 B/g Tumor und ein Tumor-Blut-Verhältnis von 3,12:1.
Fig. 4.6a Beispiel einer mit nido-Carborat modifizierten SWCNT
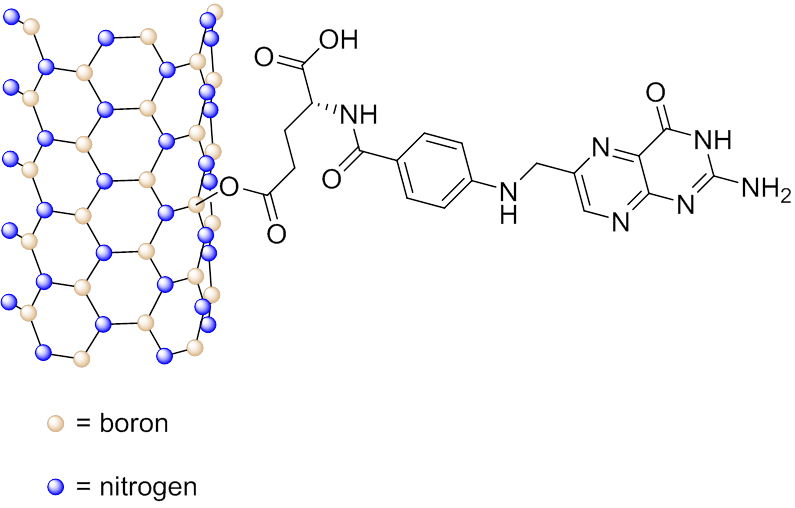
Bornitrid-Nanoröhren (boron nitride nanotubes, BNNT) sind Analoga der CNT, bei denen die Kohlenstoffatome abwechselnd durch Bor- und Stickstoffatome ersetzt sind. Es konnte gezeigt werden, dass Folat-konjugierte BNNT (Abb. 4.6b) eine erhöhte Aufnahme durch HeLa-Zellen aufweisen, wahrscheinlich aufgrund von rezeptorvermittelter Endozytose, und mit den Lysosomen in den Zellen kolokalisiert sind.
Fig. 4.6b Schematische Darstellung von an ein BNNT konjugiertes Folsäuremolekül