Verschiedene borhaltige Verbindungen mit niedrigem Molekulargewicht wurden entwickelt, um mit Rezeptoren oder Transportern zu interagieren, die auf der Oberfläche von Tumorzellen überexprimiert sind. Solche überexprimierten Rezeptoren oder Transporter sind hochattraktive Ziele für die selektive BNCT, da die borhaltigen Wirkstoffe so konzipiert sind, dass sie spezifisch mit diesen Rezeptoren oder Transportern interagieren und sich so durch Transport in die malignen Zellen selektiv anreichern. Hauptaufgabe bei der Synthese solcher Borverbindungen ist die Erzeugung bioverfügbarer Moleküle, die eine ausreichende Wasserlöslichkeit besitzen, zu einer hohen Anreicherung von Bor in den Zellen führen, ein vorhersagbares Verhalten in lebenden Organismen zeigen und eine geringe Cytotoxizität aufweisen.
Boronsäuren, Carborane und verschiedene Bor-Cluster wurden als 10B-Einheiten ausgewählt. Vielversprechende borhaltige Moleküle, die im letzten Jahrzehnt beschrieben wurden, werden hier in sechs Klassen eingeteilt: Aminosäurederivate, Nukleinsäurederivate, Porphyrine und verwandte Derivate, Kohlenhydrate, Peptide und DNA- oder Mitochondrien-adressierende Moleküle.
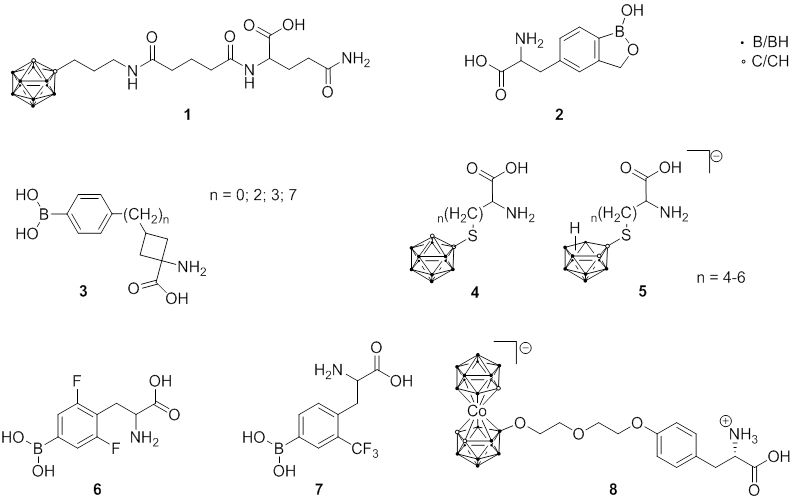
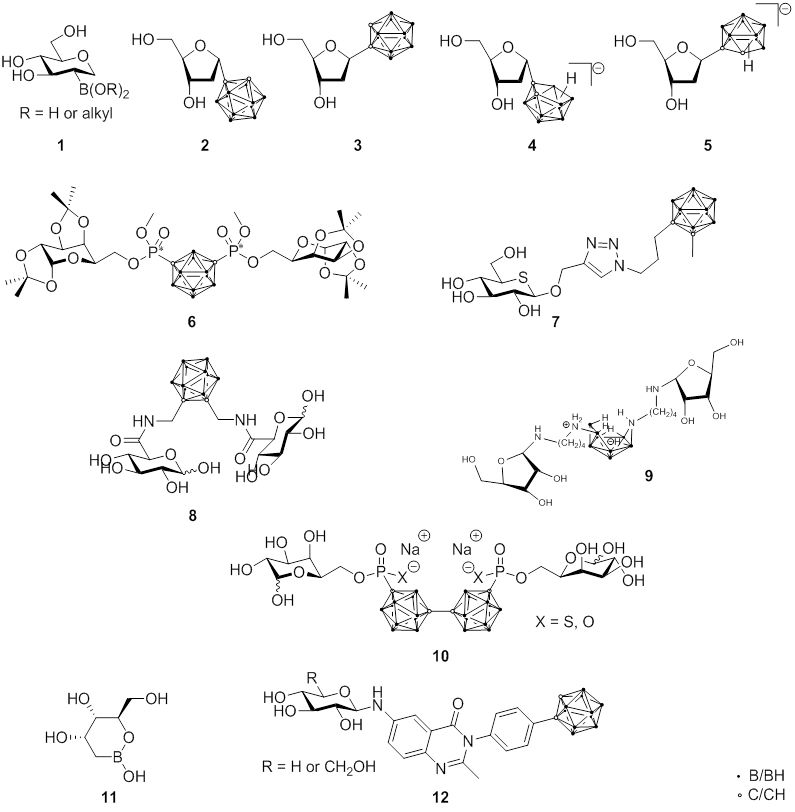
Da sich L-10BPA als Aminosäurederivat aktiv in malignen Melanomzellen anreichert, wurde der Entwicklung borhaltiger Aminosäuren und verwandter Peptide viel Aufmerksamkeit geschenkt. Hierzu gehören Carboran-funktionalisierte Glutaminderivate (1), Benzoxaborol-haltige Phenylalaninanaloga (2), verschiedene borhaltige zyklische Aminosäuren (3) oder neue Aminosäuren auf Carboran-Basis (4 und 5).
Bioverteilungsstudien an Melanomtumor-tragenden Mäusen und an Ratten unter Verwendung des F98-Rattengliommodells zeigten, dass ausgewählte borhaltige Aminosäuren (6 und 7) selektiv von den Tumoren aufgenommen wurden. Darüber hinaus wurden fluorierte (18F) BPA-Derivate synthetisiert, um die Entwicklung praktischer Hilfsmittel, sowohl für die Magnetresonanztomographie (MRT) als auch für BNCT-Reagenzien, voranzutreiben. In jüngerer Zeit konzentrierte sich die Forschung auf die Synthese von Cobaltbis(dicarbollid)-haltigen Aminosäuren (8), die 18 Boratome enthalten, um die Borbeladung zu erhöhen.
Fig. 2.1 Molekülstrukturen borhaltiger Aminosäuren
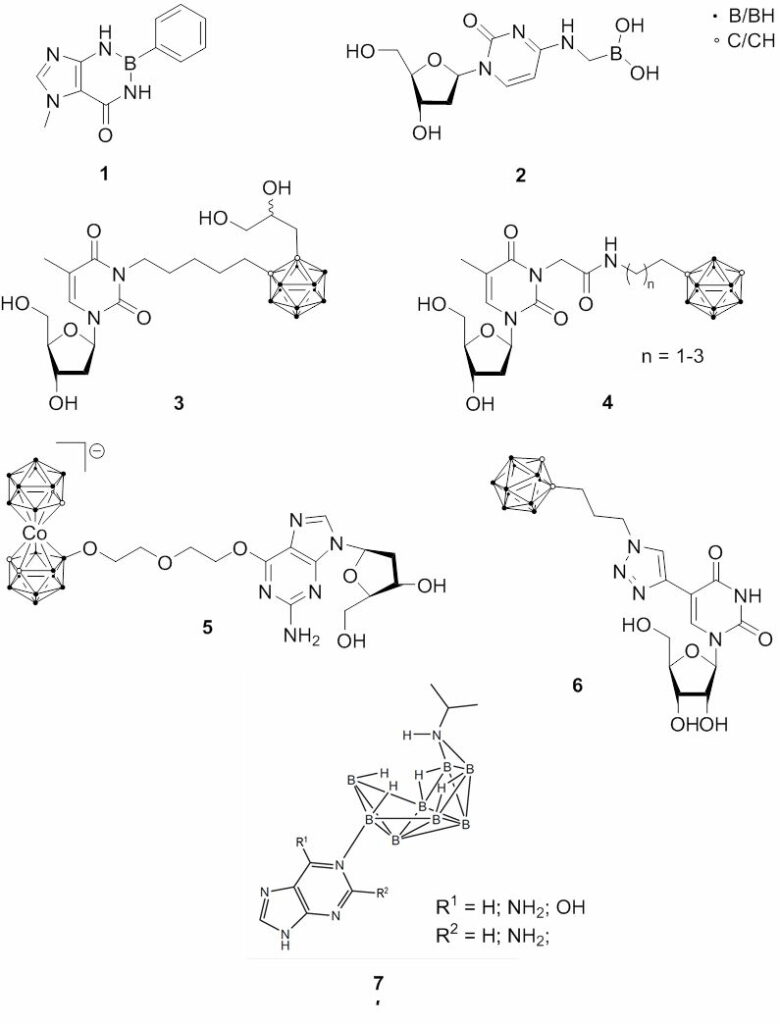
Anfängliche Ansätze konzentrierten sich auf den Einbau von Bor in Nukleobasen, wie Purine (1) und Pyrimidine. Ein anderer Ansatz war die direkte Konjugation eines borhaltigen Restes mit Nukleinsäuren; zum Beispiel wurde 2′-Desoxycytidin mit Methylboronsäure modifiziert (2). In den 1990er Jahren wurden verschiedene Konjugate von Boronsäuren und Carboranderivaten mit Nukleinsäuren entwickelt. Zu den jüngsten Fortschritten bei borhaltigen Nukleosidkonjugaten gehören Carboran-haltige Thymidin-Analoga (3 und 4) und Metallacarboran-Derivate als Thymidinkinase 1 (TK1)-Substrate, die auch mit dem RG2-Rattengliommodell und dem F98-Rattengliommodell getestet wurden. Es sind auch Derivate bekannt, die Amino-, Amido- oder komplexere stickstoffhaltige Gruppen in der Verknüpfungseinheit oder gar keine verknüpfende Einheit zwischen dem Nukleosid und dem Carboran tragen.
Metallacarboran-Derivate aller vier kanonischen Nukleoside, Thymidin (T), 2′-O-Desoxycytidin (dC), 2′-O-Desoxyadenosin (dA) und 2′-O-Desoxyguanosin (dG) (5), wurden hergestellt. Diese Methodik ermöglichte die Untersuchung eines breiten Spektrums von metallhaltigen Nukleosidkonjugaten und den Einbau dieser Metallzentren an bestimmten Stellen in DNA-Oligomeren. Es wurden auch neue Uridinderivate entwickelt, die ortho-Carboran tragen und über einen Ethinyl- und/oder einen Triazolring miteinander verbunden sind (6). Diese Verbindungen zeigen nur eine geringe bis mittlere Cytotoxizität und mäßige Phosphorylierungsraten, die ein Indikator für den potentiellen DNA-Einbau sind. Zusätzlich wurde die Phosphorylierungsrate dieser Derivate durch TK1 und TK2 untersucht. Es wurde festgestellt, dass Nukleoside, die die Cobalt-bis(dicarbollid)-Einheit oder die Dicarba-closo-dodecaboranyl-Einheit enthalten, zur Aggregation neigen, während Nukleoside, die ein nido-Carborat tragen, eine stabile wässrige Lösung bilden.
Exotischere Beispiele sind die Synthese von Azanonaboran-Derivaten von Purin, Adenin, Guanin und 2,6-Diaminopurin (7). Hier kann die exo-NH2R-Gruppe des Azanonaborans durch ein Stickstoffatom des Pyrimidinrings und, mit Ausnahme von Guanin, auch durch ein N-Atom des Imidazolrings ausgetauscht werden.
Fig. 2.2 Molekülstrukturen borhaltiger Nukleoside
Es ist bekannt, dass Porphyrine und ihre Analoga wie Chlorine, Phthalocyanine und Porphyrazine sich selektiv in einer Vielzahl von Tumoren anreichern. Des Weiteren werden diese Verbindungen in der photodynamischen Therapie (PDT) zur Krebsbehandlung als Photosensibilisatoren eingesetzt.
Borierte Porphyrine werden sowohl in der BNCT als auch in der PDT eingesetzt. Als Theranostika finden sie auch Verwendung, da ihre Verteilung in Zellen und Geweben durch Fluoreszenzbildgebung leicht sichtbar gemacht werden kann.
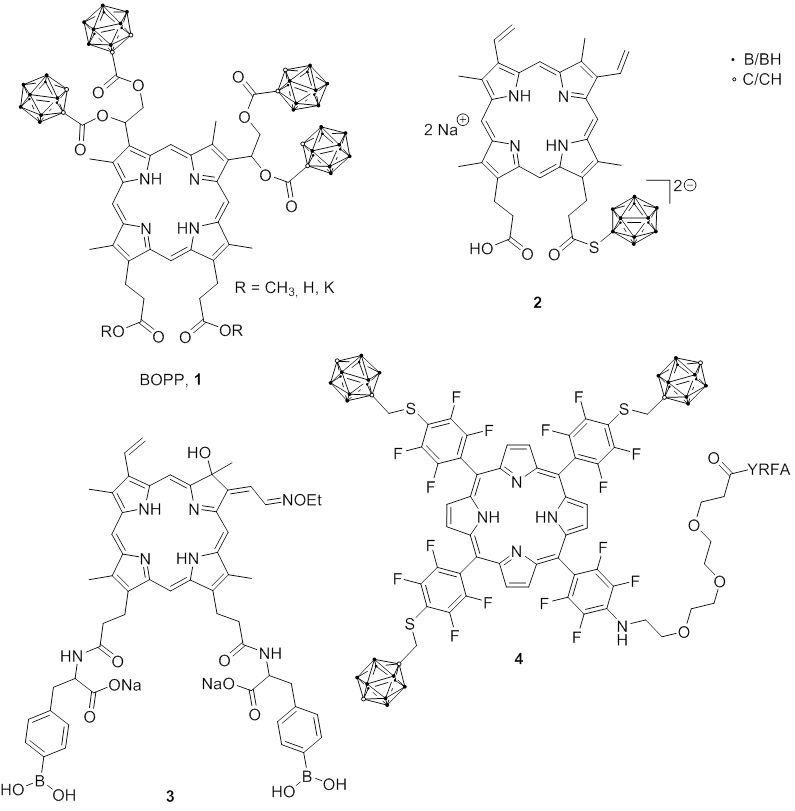
Das borierte Porphyrin BOPP (1) wurde in Xenotransplantat-Modellen von Gliomen selektiv von Tumorzellen aufgenommen und vorwiegend in den Mitochondrien lokalisiert. Anschließend wurde eine Phase-I-Arzneimittelbewertung von BOPP durchgeführt. Das Medikament konnte jedoch klinisch nicht eingesetzt werden, da bei den Patienten aufgrund der toxischen Wirkung von BOPP und/oder seiner Metaboliten auf die Thrombozyten eine Thrombozytopenie beobachtet wurde.
Zur Vermeidung dieser Nebenwirkungen wurden verschiedene andere borierte Porphyrine und ihre Analoga synthetisiert und als Bortransportmoleküle für die BNCT untersucht. Die meisten Porphyrine, die eine oder mehrere Boronsäuregruppen oder Carborane im Porphyringerüst enthalten, haben eine schlechte Wasserlöslichkeit. Daher wurden Porphyrine mit ionischen Borclustern wie nido-Carborat, Dodecaborat und Cobalt-bis(dicarbollid) entwickelt, um die Wasserlöslichkeit zu erhöhen. Es wurde ein Protoporphyrin-enthaltendes Dodecaborat (2) entwickelt, das eine hohe Wasserlöslichkeit und geringe Cytotoxizität zeigte und in verschiedenen Tumorzellen höhere interzelluläre Borkonzentrationen als BOPP aufwies. Ein Chlorinderivat mit zwei BPA-Einheiten (3) als Substituenten zeigte eine gute Wasserlöslichkeit (100 mg/mL) und Tumorselektivität.
Carboran-haltige Porphyrine wurden mit linearem und verzweigtem Polyamin und Opioidpeptid (Tyr-D-Arg-Phe-β-Ala; YRFA) (4) konjugiert, um die Permeabilität der Blut-Hirn-Schranke (BHS) zu erhöhen. Diese Konjugate zeigten in einem in-vitro-Modell eine geringe Cytotoxizität (> 400 μM) und einen hohen BHS-Permeabilitätskoeffizienten.
Fig. 2.3 Borierte Porphyrine und Chlorine
In vielen Krebszellen wird häufig eine erhöhte Glykolyserate beobachtet, und daher haben borhaltige Kohlenhydrate in letzter Zeit ein großes Interesse erregt, wie z.B. Boronsäure- und Boronsäureester-haltige Monosaccharide, die aus D-Glukal hergestellt werden (1). Es wird erwartet, dass der Zuckeranteil nicht nur dem ansonsten hydrophoben Borcluster Wasserlöslichkeit verleiht, sondern die Verbindung sich auch über das Glukose-Transportsystem selektiv in Tumorgeweben anreichert. Verschiedene wasserlösliche ortho-Carboran-haltige Glykoside, Carboranyl-C-Desoxyribosen (2 bis 5), funktionalisierte glykosylierte Carborane (6), Carboran-haltige 5-Thio-D-Glukopyranose-Derivate (7), mono-, bis- und tris-glukuronylierte Carborane (8), Ribofuranosylaminobutylazanonaborate (9), borreiche Dicarboran-überbrückte Bisglykophosphonate (10) und multivalente hantelförmige Galaktosylcarborane wurden synthetisiert und ihre biologischen Eigenschaften als Bortransportmoleküle untersucht. Es konnte gezeigt werden, dass sich o-Carboranylglukose in F98-Gliomzellen signifikant anreicherte. Ein anderer Ansatz verfolgt die Synthese von Boronsäurederivaten, die Monosaccharide imitieren (11).
Darüber hinaus wurden glykosylierte Carboranylchinazoline (12) synthetisiert und in vitro-Toxizitätsstudien mit B16-Melanomzellen durchgeführt. Es konnte gezeigt werden, dass ortho-Carboran enthaltene Derivate eine Zelltoxizität mit einem LD50-Wert von >200 µg Bor pro mL aufweisen und Derivate, die die jeweilige nido-Spezies mit einer höheren Wasserlöslichkeit enthalten, bis zu einer Borkonzentration von etwa 3000 µg Bor pro mL keine Zelltoxizität aufweisen.
Fig. 2.4 Kohlenhydrathaltige Borverbindungen
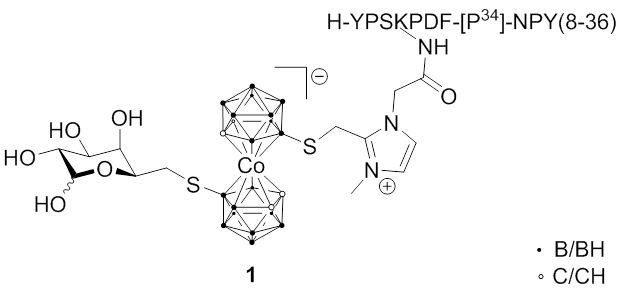
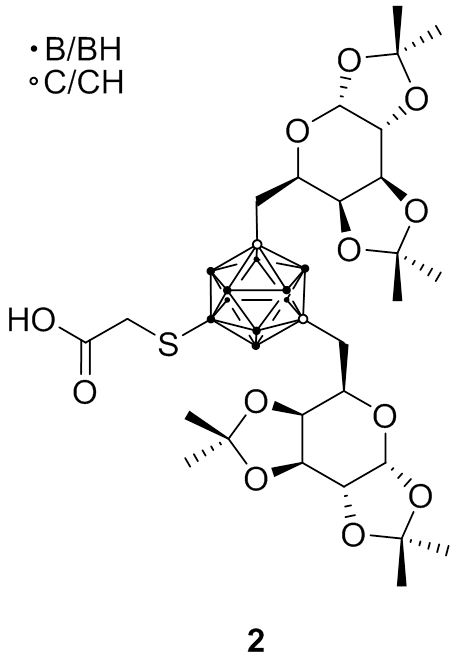
Die Gruppen von Hey-Hawkins und Beck-Sickinger haben sich auf verschiedene Peptide konzentriert, die Selektivität gegenüber G-Protein-gekoppelten Rezeptoren zeigen, die bei verschiedenen Krebsarten überexprimiert werden. Jüngste Forschungsarbeiten umfassten die Synthese von closo-Carboran-modifizierten Neuropeptid-Y-Analoga oder Metallacarboran-Derivaten (1); ein zweiter Ansatz war der Einbau von meta-Carboranen in neuartige Ghrelin-Rezeptor-Agonisten. Interessanter jedoch ist die Verbesserung dieser Derivate durch Einführung wasserlöslicher Seitenketten an den Carboran-Einheiten (2), während der Wechsel von D-Galaktosyl- zu L-Galaktosyl-Gruppen die Selektivität dieser Derivate aufgrund einer geringeren unspezifischen Aufnahme von Biokonjugaten in Lebergewebe erhöhte.
Fig. 2.5a Metallacarboran-Konjugat 1 mit tumorselektivem Neuropeptid Y
Fig. 2.5b Bis-D-galaktosyliertes meta-Carboran 2 als wasserlöslicher Baustein für tumorselektive Peptide
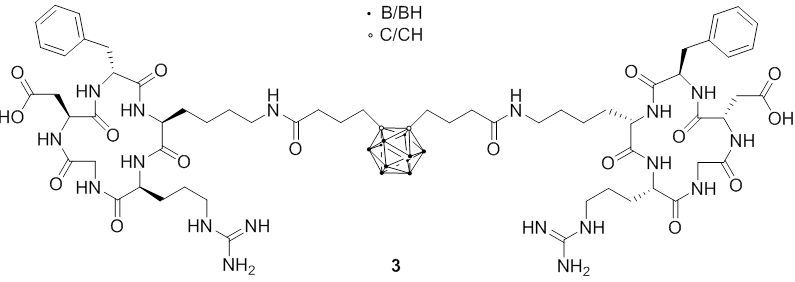
Ein weiteres attraktives Ziel ist das Integrin ανβ3, das eine spezifische Expression in proliferierenden Endothel- und Tumorzellen unterschiedlicher Herkunft aufweist. In vitro-Zelladhäsionsuntersuchungen von zyklischen Arg-Gly-Asp (cRGD)-Peptidkonjugaten mit ikosaedrischen Borclustern (BSH oder ortho-Carboran) (3) zeigten die hohe Bindungsaffinität der Konjugate an das Integrin ανβ3. Bioverteilungsexperimente zeigten eine vergleichbare Tumoraufnahme und eine signifikant längere Retention der Carboran-Konjugate in Tumoren im Vergleich zu BSH.
Fig. 2.5c cRGD-Peptid-Konjugat mit ortho-Carboran
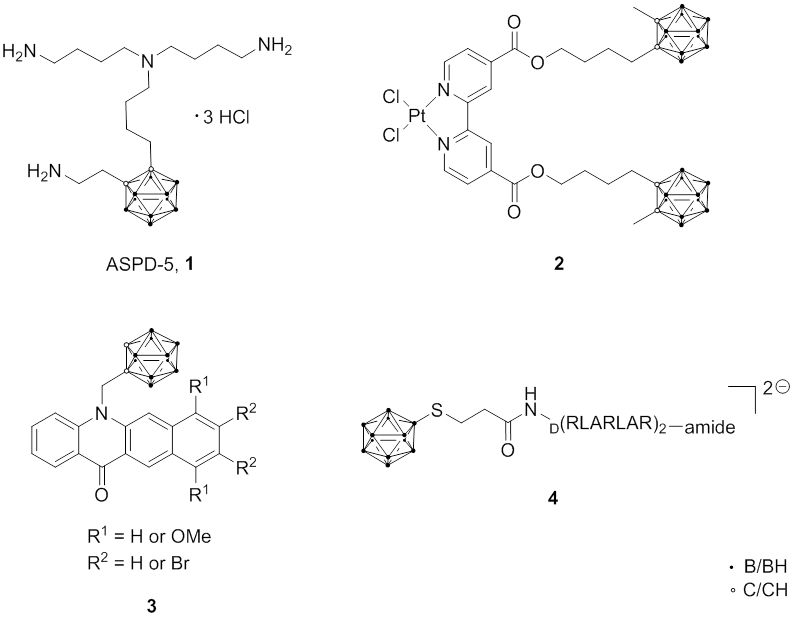
Eine der wichtigsten Eigenschaften von Bortransportmolekülen ist die Lokalisierung im Cytosol und/oder im Kern von Krebszellen. Wenn Borverbindungen spezifisch im Zellkern angereichert werden können, wird die DNA von Krebszellen durch die BNCT wirksamer zerstört. Auf der Grundlage dieser Strategie wurde über die Anreicherung borhaltiger Verbindungen wie Polyamin, DNA-bindenden Reagenzien und DNA-Interkalatoren berichtet. Im Rahmen dieses Ansatzes wurde ein Carboran-haltiges Polyamin, ASPD-5 (1), hergestellt, das eine hohe Bindungsaffinität für DNA und eine hohe Tumorselektivität zeigte. Darüber hinaus könnte es in einigen Fällen möglich sein, BNCT-Eigenschaften mit chemotherapeutischen Aspekten zu kombinieren, um so die therapeutische Gesamtwirkung zu erhöhen, z.B. mit boriertem, Cisplatin-haltigem closo-Carboran (2) oder nido-Carborat- oder Carboran-haltigen Benzo[b]acridonen (DNA-Interkalator) (3).
Ein weiteres spezifisches, intrazelluläres Ziel sind die Mitochondrien. Eine Strategie, Mitochondrien als BNCT-Ziel zu adressieren, ist die Kombination von Carboranen oder Dodecaboraten mit ausgewählten Aminosäuresequenzen, die bekanntermaßen selektiv gegenüber Mitochondrien sind; ein Beispiel ist die Konjugation von BSH mit einem Arginin-Leucin-Alanin (RLA)-Peptid (4).
Fig. 2.6 Borverbindungen für das Adressieren von DNA oder Mitochondrien